若杉 桂輔教授
大学院総合文化研究科 附属教養教育高度化機構
SDGs
連携提案
本研究室では、「生命の不思議さ」を分子レベルで理解し、病気の治療薬開発など「医療に貢献できる新たな機能性蛋白質の開拓」を目指している。特に、「がん」「脳卒中」「神経変性疾患」「感染症」等の病気や「老化」「寿命」「アンチエイジング」などに関わる天然蛋白質が持つ新たな機能を探索し、その機能制御メカニズムを解明するとともに、より優れた機能を持つ新規機能性蛋白質を創製することを軸に研究を行っている。また、生物の進化に伴う天然蛋白質の機能獲得・進化プロセスに着目した理学的な基礎研究も行っている。
共同研究開発や研究成果の応用に関心のある企業との連携を希望する。
共同研究開発や研究成果の応用に関心のある企業との連携を希望する。
事業化プロポーザル
-
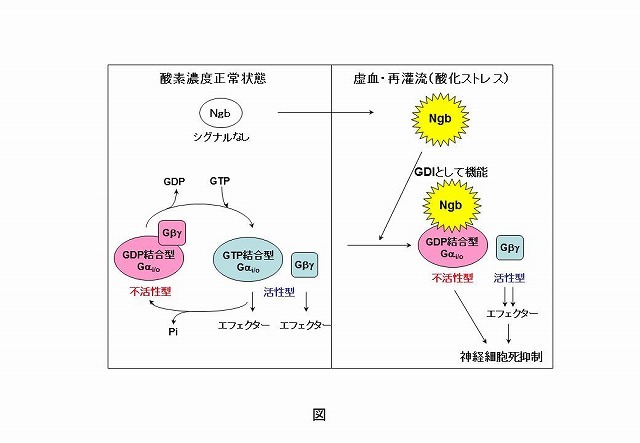 虚血性脳疾患における脳内グロビン蛋白質の神経細胞死防止機能の発見と応用脳卒中は、突然に脳血管の破損(脳出血、くも膜下出血)や閉塞(脳梗塞、脳閉塞)のため、脳細胞に栄養や酸素が供給されなくなる虚血性疾患で、直ちに処置しなければ、半身マヒや言語障害、意識障害などの重篤な神経障害をもたらす。近年、脳内には特異的に発現しているグロビン蛋白質であるニューログロビン(Ngb)の存在が知られていたが、機能の詳細は未知であった。 この研究室では、医療に貢献できる新機能性蛋白質の開拓を目指している。最近、ヒトNgbが虚血・再潅流(酸化ストレス)時に立体構造を大きく変え、細胞内シグナル伝達蛋白質と結合して、神経細胞死を防ぐことを発見した。この結果から、グロビンは酸素結合蛋白質としてだけ働くという従来の固定観念をくつがえし、酸化ストレス応答性のシグナル伝達センサーとして機能するという全く新たな概念を打ち立てた。 更に、ゼブラフィッシュのNgbは細胞膜貫通性があることに着目し、ヒト及びゼブラフィッシュNgb間の新規キメラ蛋白質を創製した。このキメラ蛋白質は神経細胞の外に加えるだけで細胞内に導入され、虚血・再潅流時に細胞死保護作用を発揮させることに成功した。
虚血性脳疾患における脳内グロビン蛋白質の神経細胞死防止機能の発見と応用脳卒中は、突然に脳血管の破損(脳出血、くも膜下出血)や閉塞(脳梗塞、脳閉塞)のため、脳細胞に栄養や酸素が供給されなくなる虚血性疾患で、直ちに処置しなければ、半身マヒや言語障害、意識障害などの重篤な神経障害をもたらす。近年、脳内には特異的に発現しているグロビン蛋白質であるニューログロビン(Ngb)の存在が知られていたが、機能の詳細は未知であった。 この研究室では、医療に貢献できる新機能性蛋白質の開拓を目指している。最近、ヒトNgbが虚血・再潅流(酸化ストレス)時に立体構造を大きく変え、細胞内シグナル伝達蛋白質と結合して、神経細胞死を防ぐことを発見した。この結果から、グロビンは酸素結合蛋白質としてだけ働くという従来の固定観念をくつがえし、酸化ストレス応答性のシグナル伝達センサーとして機能するという全く新たな概念を打ち立てた。 更に、ゼブラフィッシュのNgbは細胞膜貫通性があることに着目し、ヒト及びゼブラフィッシュNgb間の新規キメラ蛋白質を創製した。このキメラ蛋白質は神経細胞の外に加えるだけで細胞内に導入され、虚血・再潅流時に細胞死保護作用を発揮させることに成功した。 -
 エクソンを機能性単位とする組換え蛋白質の創製と新規機能性の探索真核生物の遺伝子では、翻訳されるDNA塩基配列(エクソン)は、翻訳されない塩基配列(イントロン)によって分断されている。このエクソンは蛋白質の機能単位に対応しており、イントロンを「のりしろ」とするエクソンの組み換え(エクソン・シャッフリング)により、蛋白質が進化したとの仮説がある。また、立体構造解析から、蛋白質は連続した10~40残基前後のアミノ酸残基からなる構造単位(モジュール)から構成されており、エクソンは、このモジュールに対応していることが提唱されている。 この研究室では、このような蛋白質のモジュール・シャッフリング仮説に着目し、新規蛋白質の創製と機能解析を研究している。即ち、エクソン遺伝子の組合せを設計し、大腸菌や酵母菌で発現させて様々なモジュール置換蛋白質を作製すると共に、この置換蛋白質の構造及び機能を解析している。現在、細胞増殖、分化、細胞死などを人工的に制御にする新規蛋白質の創製を目指している。
エクソンを機能性単位とする組換え蛋白質の創製と新規機能性の探索真核生物の遺伝子では、翻訳されるDNA塩基配列(エクソン)は、翻訳されない塩基配列(イントロン)によって分断されている。このエクソンは蛋白質の機能単位に対応しており、イントロンを「のりしろ」とするエクソンの組み換え(エクソン・シャッフリング)により、蛋白質が進化したとの仮説がある。また、立体構造解析から、蛋白質は連続した10~40残基前後のアミノ酸残基からなる構造単位(モジュール)から構成されており、エクソンは、このモジュールに対応していることが提唱されている。 この研究室では、このような蛋白質のモジュール・シャッフリング仮説に着目し、新規蛋白質の創製と機能解析を研究している。即ち、エクソン遺伝子の組合せを設計し、大腸菌や酵母菌で発現させて様々なモジュール置換蛋白質を作製すると共に、この置換蛋白質の構造及び機能を解析している。現在、細胞増殖、分化、細胞死などを人工的に制御にする新規蛋白質の創製を目指している。 -
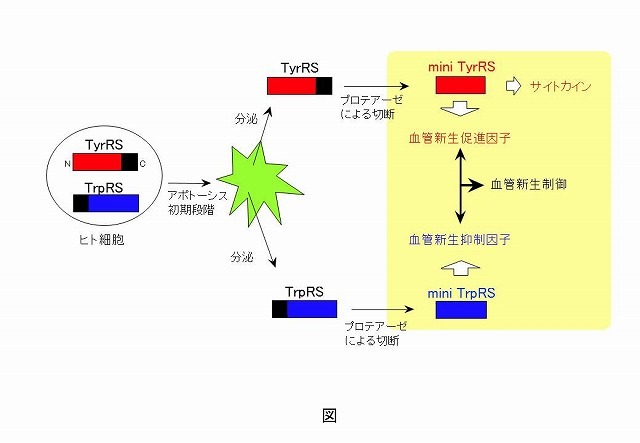 アミノアシルtRNA合成酵素ドメインの血管新生に係る新規機能の解明と応用チロシルtRNA合成酵素(TyrRS)とトリプトファニルtRNA合成酵素(TrpRS)は、tRNAに夫々チロシン及びトリプトファンを結合させる蛋白質合成を触媒する過程において重要な酵素であると認識されていた。 最近、意外なことにtRNA合成酵素が全く別の機能を持つことが判明した。即ち、この研究者らは、ヒトTyrRSがアポトーシスの初期段階で細胞から分泌され、余分な付加ドメインがプロテアーゼで切断された後、触媒活性ドメイン、及び付加ドメインが夫々、好中球活性化、単球活性化をもたらす2種類のサイトカインとして働くことを発見した。更に、ヒトTyrRSの触媒活性ドメインは血管新生促進因子として働くこと、他方、ヒトTrpRSの触媒活性ドメインは逆に血管新生抑制因子として働くことを明らかにした。 この研究室では、医療に貢献できる新機能性蛋白質の開拓を目指しているが、引き続き、このヒトTyrRS, 及びヒトTrpRSの血管新生に関する制御メカニズムの解明、並びに、これら蛋白質の分子進化過程の解明を行っている。更に、この新しい概念を展開するために、アミノアシルtRNA合成酵素の更なる新機能の探索にも挑んでいる。
アミノアシルtRNA合成酵素ドメインの血管新生に係る新規機能の解明と応用チロシルtRNA合成酵素(TyrRS)とトリプトファニルtRNA合成酵素(TrpRS)は、tRNAに夫々チロシン及びトリプトファンを結合させる蛋白質合成を触媒する過程において重要な酵素であると認識されていた。 最近、意外なことにtRNA合成酵素が全く別の機能を持つことが判明した。即ち、この研究者らは、ヒトTyrRSがアポトーシスの初期段階で細胞から分泌され、余分な付加ドメインがプロテアーゼで切断された後、触媒活性ドメイン、及び付加ドメインが夫々、好中球活性化、単球活性化をもたらす2種類のサイトカインとして働くことを発見した。更に、ヒトTyrRSの触媒活性ドメインは血管新生促進因子として働くこと、他方、ヒトTrpRSの触媒活性ドメインは逆に血管新生抑制因子として働くことを明らかにした。 この研究室では、医療に貢献できる新機能性蛋白質の開拓を目指しているが、引き続き、このヒトTyrRS, 及びヒトTrpRSの血管新生に関する制御メカニズムの解明、並びに、これら蛋白質の分子進化過程の解明を行っている。更に、この新しい概念を展開するために、アミノアシルtRNA合成酵素の更なる新機能の探索にも挑んでいる。